Miten sähköajoneuvon litiumioniakku toimii?
Nähtyään toisessa artikkelissa lyijyakun toiminnan, jolla kaikki autot on varustettu, katsotaanpa nyt sähköajoneuvon ja erityisesti sen litiumakun toimintaperiaatetta ...

Prinssi
Kuten kaikissa akuissa, periaate pysyy samana: nimittäin tuottaa energiaa (tässä sähköä) kemiallisen tai jopa sähköisen reaktion seurauksena, koska kemia on aina sähkön vieressä. Itse asiassa atomit itsessään on tehty sähköstä: nämä ovat elektroneja, jotka pyörivät ytimen ympärillä ja jotka jollakin tavalla muodostavat atomin "kuoren" tai jopa sen "kuoren". Kun tiedetään myös, että vapaat elektronit ovat lentäviä ihon paloja, jotka viettävät aikaansa liikkuessaan atomista toiseen (kiittymättä siihen), tämä koskee vain johtavia materiaaleja (riippuu elektronikerrosten lukumäärästä ja elektronien määrästä). viimeistä ammusta kohti).
Otamme sitten "palan ihoa" atomeista (siis osan sen sähköstä) kemiallisen reaktion kautta tuottaaksemme sähköä.

perusteet
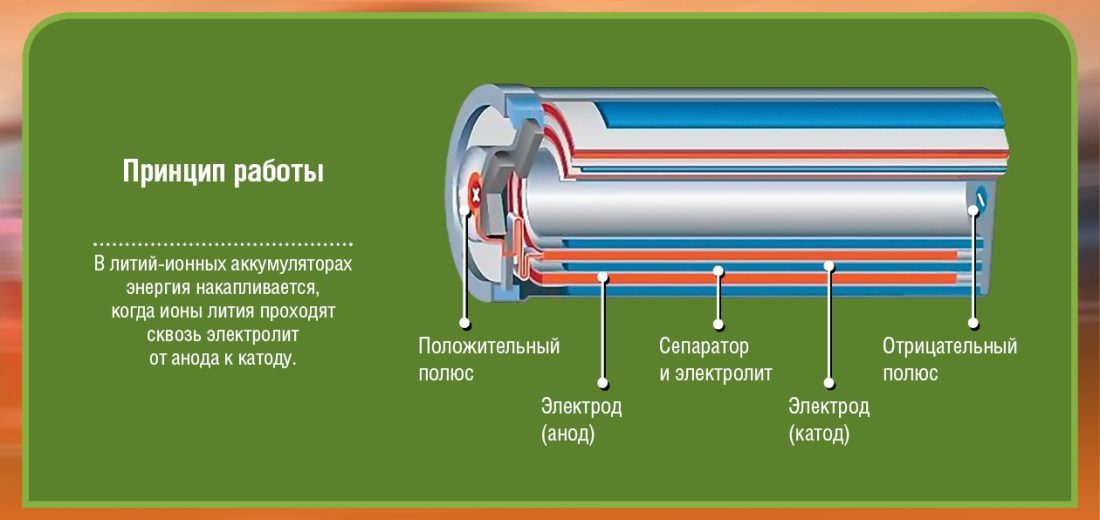
Ensinnäkin on kaksi napaa (elektrodia), joita kutsumme katodi (+ napa: litium-kobolttioksidissa) ja anodi (pääte -: hiili). Jokainen näistä navoista on valmistettu materiaalista, joka joko poikkeuttaa elektroneja (-) tai vetää puoleensa (+). Kaikki on tulvinut elektrolyytti joka mahdollistaa kemiallisen reaktion (materiaalin siirtymisen anodilta katodille) sähkön tuotannon seurauksena. Näiden kahden elektrodin (anodi ja katodi) väliin asetetaan este oikosulkujen välttämiseksi.
Huomaa, että akku koostuu useista kennoista, joista jokainen muodostuu kaavioissa näkyvästä. Jos esimerkiksi säilytän 2 2 voltin kennoa, minulla on vain 4 volttia akun lähdössä. Useita satoja kiloja painavan auton käynnistämiseksi kuvittele kuinka monta kennoa tarvitaan ...
Mitä kaatopaikalla tapahtuu?
Oikealla ovat litiumatomit. Ne on esitetty yksityiskohtaisesti, ja keltainen sydän edustaa protoneja ja vihreä sydän edustaa elektroneja, joita ne kiertävät.
Kun akku on ladattu täyteen, kaikki litiumatomit ovat anodin (-) puolella. Nämä atomit koostuvat ytimestä (joka koostuu useista protoneista), jonka positiivinen sähkövoima on 3, ja elektroneista, joiden negatiivinen sähkövoima on 3 (yhteensä 1, koska 3 X 3 = 1). ... Siksi atomi on stabiili kolmella positiivisella ja kolmella negatiivisella (se ei houkuttele tai käännä elektroneja).
Irrotamme litiumista elektronin, joka osoittautuu olevan vain kahdella: sitten se vetää puoleensa + ja kulkee osion läpi.
Kun kosketan +- ja -napojen välillä (eli kun käytän akkua), elektronit siirtyvät -liittimestä + -napaan akun ulkopuolista sähköjohtoa pitkin. Nämä elektronit ovat kuitenkin peräisin litiumatomien "hiuksista"! Periaatteessa 3 ympärillä pyörivästä elektronista repeytyy 1 irti ja atomista on jäljellä enää 2. Yhtäkkiä sen sähkövoima ei ole enää tasapainossa, mikä aiheuttaa myös kemiallisen reaktion. Huomaa myös, että litiumatomista tulee litiumioni + koska nyt se on positiivinen (3 - 2 = 1 / Ydin arvo on 3 ja elektronit 2, koska menetimme yhden. Lisäämällä saadaan 1, ei 0 kuten ennen. Siksi se ei ole enää neutraali).
Epätasapainosta johtuva kemiallinen reaktio (kun elektronit on rikottu virran saamiseksi) johtaa lähettämiseen litiumioni + katodille (liitin +) seinän läpi, joka on suunniteltu eristämään kaikki. Lopulta elektronit ja ionit + päätyvät +-puolelle.
Reaktion lopussa akku tyhjenee. Nyt on tasapaino +- ja -liittimien välillä, mikä estää nyt sähkönsyötön. Pohjimmiltaan periaate on saada aikaan masennus kemiallisella/sähköisellä tasolla sähkövirran luomiseksi. Voimme ajatella tätä joena, mitä enemmän se kaltevaa, sitä tärkeämpää on virtaavan veden voimakkuus. Toisaalta, jos joki on litteä, se ei enää virtaa, mikä tarkoittaa, että akku on tyhjä.
Ladata?
Lataaminen koostuu prosessin kääntämisestä päinvastaiseksi ruiskuttamalla elektroneja tiettyyn suuntaan - ja poistamalla lisää imulla (se on vähän kuin joen veden täydentämistä käyttääkseen sen virtaa uudelleen). Siten akussa kaikki palautuu sellaiseksi kuin se oli ennen sen purkamista.
Pohjimmiltaan purkaessamme käytämme kemiallista reaktiota, ja kun lataamme, palautetaan alkuperäiset tavarat (mutta siihen tarvitaan energiaa ja siksi latausasemaa).
Pitää päällä?
Litiumakut kuluvat nopeammin kuin vanhat hyvät lyijyakut, joita on käytetty autoissamme vuosisatoja. Elektrolyytillä on taipumus hajota, kuten elektrodeilla (anodi ja katodi), mutta on myös otettava huomioon, että elektrodeihin muodostuu kerrostumia, joka vähentää ionien siirtymistä puolelta toiselle ... Erikoislaitteet mahdollistavat ottaa talteen käytetyt akut purkamalla ne erityisellä tavalla.
Mahdollisten jaksojen lukumääräksi (purkaus + täysi lataus) on arvioitu noin 1000-1500, joten puolijaksolla latauksessa 50-100% 0-100% sijasta. LÄMMITYS vahingoittaa myös vakavasti litiumioniakkuja, jotka kuumenevat, kun ne kuluttavat liikaa virtaa.
Katso myös: Kuinka säästän sähköautoni akkua?
Moottorin teho ja akku...
Toisin kuin lämpökamerassa, polttoainesäiliö ei vaikuta tehoon. Jos sinulla on 400 hv moottori, 10 litran säiliö ei estä sinua saamasta 400 hv, vaikka se olisi hyvin lyhytaikaista... Sähköautolle tämä ei ole ollenkaan sama! Jos akku ei ole tarpeeksi tehokas, moottori ei pysty käymään täydellä teholla... Näin on joissakin malleissa, joissa moottoria ei voi koskaan työntää äärirajoilleen (ellei omistaja viuhtele ja lisää suuren kaliiperin akkua !).
Otetaan nyt selvää: kuinka SÄHKÖMOOTTORI toimii
Kaikki kommentit ja reaktiot
Dernier kommentti lähetetty:
mao (Päivämäärä: 2021, 03:03:15)
erittäin hyvää työtä
Il I. 1 reaktioita tähän kommenttiin:
- hallintomies SIVUSTON HALLINTA (2021-03-03 17:03:50): Tämä kommentti on vielä parempi 😉
(Viestisi näkyy kommentin alla vahvistuksen jälkeen)
Kirjoita kommentti
Mitä mieltä olet valmistajien ilmoittamista kulutusluvuista?
